組織圖
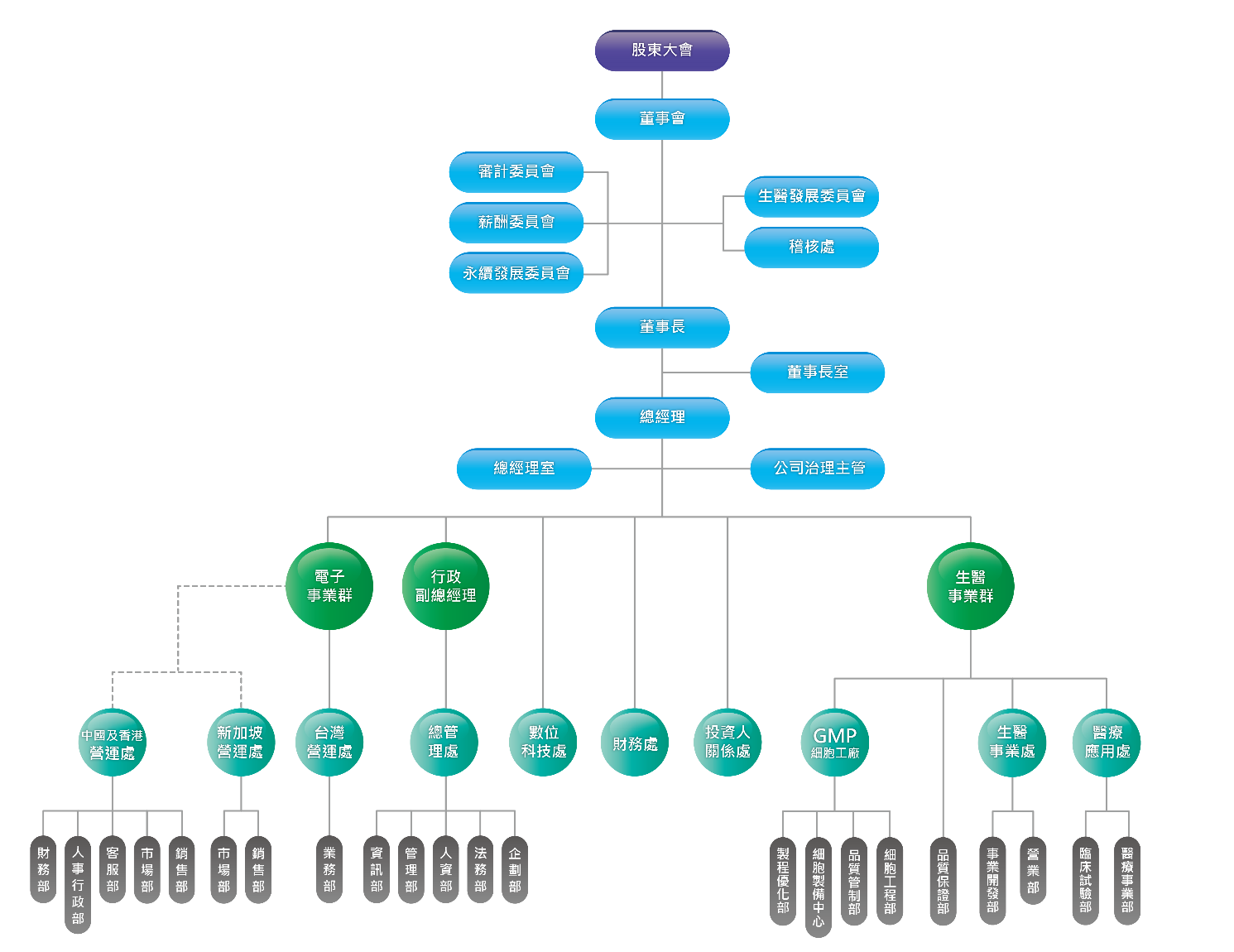
各部室職掌
- 稽核處
-
- 協助董事會及經理人檢查及覆核內控制度之缺失及衡量營運之效果與效率,並適時提拱改進建議。
- 各項營運循環之查核與追蹤。
- 執行本單位風險評估及相應規避措施。
- 董事長室
-
- 協助董事長規劃集團各項重要政策、方針及改善對策,必要時得設置專案小組負責之。
- 協助董事長或獨立董事召集各項會議暨聯繫、寄發、撰寫各項議案(例:董事會、薪資報酬委員會、審計委員會、股東常(臨時)會)...等股務相關事宜。
- 協助董事長與董事或各部門間之溝通與協調暨執行交辦任務。
- 監督風險相關事務。
- 總經理室
-
- 綜理全公司各項企劃案之擬定、評估與推行。
- 執行各部門協調及制度規劃等。
- 彙整與評估風險相關事務。
- 執行公司治理相關事務。
- 公司治理主管
-
- 綜理公司治理相關事務。
- 公司治理相關風險之評估和執行。
- 總管理處
-
- 統籌管控集團人資、法務、行政、總務、營繕、採購(電子事業相關產品除外)、企劃、資訊、資金放行等各項事務。
- 執行本單位風險評估及相應規避措施。
- 資訊部
-
- 負責集團內部各單位作業系統資訊化、電腦化、資訊整合、資安管理等之規劃、建置與維護。
- 執行本單位風險評估及相應規避措施。
- 管理部
-
- 負責集團總務、營繕相關事宜。
- 負責集團固定資產及內外部之物品、設備之採購(電子事業相關商品除外)及管理。
- 負責集團內資金放行作業。
- 負責環境保護和職業安全之相關事務。
- 執行本單位風險評估及相應規避措施。
- 人資部
-
- 責集團人員招聘與配置、人員培訓與開發、人力資源規劃、薪酬管理、績效管理、勞動關係管理及行政作業管理等業務。
- 負責集團內薪資、獎金覆核作業。
- 執行本單位風險評估及相應規避措施。
- 法務部
-
- 負責訂定集團內與公司治理有關辦法、法令規章釋疑、法務、訴訟相關業務。
- 執行本單位風險評估及相應規避措施。
- 企劃部
-
- 產業情報資訊蒐集、整合及市場分析。
- 公司對外網站之規劃、設計、行銷與維護。
- 產品功能、市場定位、經營方針、策略訂定及跨部門溝通協調。
- 產品政策、行銷計劃、廣告企劃、行銷通路整合、市場策略規劃與推動。
- 執行本單位風險評估及相應規避措施。
- 財務處
-
- 負責集團內財務管理資訊提供與分析。
- 負責集團內財務調度、資金管理等業務。
- 負責集團內帳務處理、報表編製及稅務規劃。
- 負責集團內預算彙編及管理等業務。
- 負責集團內股務作業、股東會、董事會、功能性委員會及公司治理相關事宜作業等業務。
- 執行本單位風險評估及相應規避措施。
- 數位科技處
-
- 負責實驗 室數據與臨床數據等資訊之數位化。
- 於未來導入 AI 技術與 應用方案。
- 執行本單位風險評估及相應規避措施。
- 投資人關係處
-
- 建構公司與自然人、法人、媒體、主管機關的互動關係。
- 協助公司財務、業務等部門拓展對外關係。
- 規劃及舉辦法說會及協助記者會等事項。
- 撰寫中英文營運及產業分析、財務分析報告。
- 管理、更新網站及維護相關資料。
- 負責公司對外發言任務。
- 執行本單位風險評估及相應規避措施。
電子事業群
管理台灣營運處、中國及香港營運處、新加坡營運處相關事務。
執行本單位風險評估及相應規避措施。
- 台灣營運處
-
- 統籌台灣各地電子營運事宜。
- 執行本單位風險評估及相應規避措施。
- 業務部
-
- 負責電子所有產品線採購及規劃事宜。
- 負責電子產品市場調查、研究分析、產品銷售計劃之訂定及解決客戶產品設計及製程問題。
- 集團內電子商品庫存、出貨等作業及管理。
- 應收帳款之催討及進度追蹤。。
- 執行本單位風險評估及相應規避措施。
- 中國及香港營運處
-
- 統籌中國及香港各地電子營運事宜。
- 執行本單位風險評估及相應規避措施。
- 新加坡營運處
-
- 統籌新加坡及東南亞各地電子營運事宜。
- 執行本單位風險評估及相應規避措施。
生醫事業群
管理生產營運處、生醫處、醫療應用處及品保部之相關事務。
執行本單位風險評估及相應規避措施。
- 品質保證部
- (品保部)
-
- 品保:執行廠區符合醫藥法規規範之品質系統及確效作業管理、建立與執行符合醫藥法規規定之稽∕查核作業及後續矯正與預防措施、廠內品質系統人員訓練管理、與品質程序作業制定維持等品質系統化活動及標準,以期產品與服務可以達到應具備之品質要求任務。
- 品質文管:綜理廠區品質系統文件管制與歸檔管理作業。
- 綜理品質偏離案件、客戶查廠事宜。
- 執行本單位風險評估及相應規避措施。
- GMP細胞工廠
- (細胞廠)
-
- 統籌細胞製劑工廠(符合PIS/C GMP及GTP規範)之管理事宜。
- 統籌測試實驗室(TAF認證)之管理事宜。
- 統籌各項產品之生命週期(包括但不限於生產、檢測及放行之管理等等)。
- 整合處內之各類專案,依公司相關管理辦法導入研發循環,並進行各專案進度管控。
- 人才選定、培育及留任。
- 執行本單位風險評估及相應規避措施。
- 製程優化部
-
- 負責建置及維護現行產品製程之標準化與優化作業。
- 以技術導向進行製程監控及追蹤廠內產品品質。 負責建置、維護或管理產線作業程序書及表單。
- 執行本單位風險評估及相應規避措施。
- 細胞製備中心
-
- 製造課:執行細胞治療產品之委託生產製造相關作業。
- 生管課:綜理廠區生產排程及倉儲庫存之管理作業。
- 廠務課:維護及管理廠區之設施、設備及儀器等確效驗證作業。
- 執行本單位風險評估及相應規避措施。
- 品質管制部
-
- 品管課:負責品管部門行政庶務、執行進料與出貨之品質管制檢測作業。
- 測試實驗室:建立及開發細胞製劑之檢測平台,及客製化試驗。且依ISO/IEC 17025,2017符合認證實驗室運作並取得TAF認證,並接受廠內外委託檢測作業。
- 測試實驗室(TAF認證)之維護及管理事宜。
- 執行本單位風險評估及相應規避措施。
- 細胞工程部
-
- 負責分析、評估及執行特定專案。
- 建置及執行專案之GTP產線生產製造相關作業。
- 執行本單位風險評估及相應規避措施。
- 生醫事業處
- (生醫處)
-
- 統籌公司對外新技術之評估導入事宜。
- 協助轄下單位推廣公司之技術與產品。
- 整合處內各類專案依公司相關管理辦法導入研發循環,並進行各專案之進度管控。
- 定期依據公司相關管理辦法,將營業秘密呈報營業秘密委員會。
- 智財管理:將本處研發成果以不同之形式實現,如:專利權申請與維護、學術期刊發表、營業祕密、著作權、其他公開出版品之管理。
- 人才選定、培育及留任。
- 執行本單位風險評估及相應規避措施。。
- 事業開發部
-
- 負責技術、產品、變更、產官學研醫合作等各類型專案之資料收集與分析及可行性評估。
- 統籌公司對外新技術之評估導入事宜。
- 執行本單位風險評估及相應規避措施。
- 營業部
-
- 營業課:對外推廣業務。
- 事業發展課:行銷規劃、策略訂定、協助營業部後勤與客戶服務等相關事務。
- 執行本單位風險評估及相應規避措施。
- 醫療應用處
- (醫應處)
-
- 統籌公司新醫療事業之發展評估,新應用之臨床開發事宜。
- 負責國內、外事業開發與公司合作模式規劃及導入事宜。
- 統籌國內生技相關政府機構及法人之合作與策略發展等事宜。
- 執行本單位風險評估及相應規避措施。
- 臨床試驗部
-
- 負責蒐集並評估新產品及既有產品新臨床應用之開發。
- 負責蒐集並與專科醫師討論評估產品臨床應用之可行性及引進。
- 負責新產品及既有產品於各醫院實際應用之後續追蹤與管理。
- 執行本單位風險評估及相應規避措施。
- 醫療事業部
-
- 協助推動生技小組資訊蒐集及製作評估報告等相關事宜。
- 負責再生醫學產品之上市計劃。
- 負責國外再生醫學產品及醫療技術之評估、引進及後續推展。
- 蒐集國內、外再生醫療之最新技術、專利、資訊及相關公司的資料之分析與評估事宜。
- 連結國內政府機構及相關法人,透過合作建立再生醫學策略聯盟,深耕國內再生醫療產業。
- 負責國內醫療技術之導入與評估事宜。
- 負責國內醫療技術及教育訓練之規劃與管理。
- 負責評估醫療器材及再生醫學產品之服務及推廣業務。
- 執行本單位風險評估及相應規避措施。